乳腺癌的转移是导致患者预后不良的核心因素。传统的检测方法存在灵敏度不足、侵入性强以及无法实时反映肿瘤微环境动态变化的问题,难以满足精准诊疗的需求。近年来,表面增强拉曼光谱(surface⁃enhanced Raman scattering,SERS)技术凭借其单分子级别的高灵敏度、优异的时空分辨率以及多重靶标检测能力,成为乳腺癌转移监测与治疗评估的重要工具。靶向肿瘤或肿瘤标志物的功能化SERS探针可以非侵入性地识别循环肿瘤细胞(circulating tumor cells, CTCs)、外泌体(exosomes,exos)及与转移相关的代谢物,实现乳腺癌转移的分子水平诊断。此外,SERS技术还可以检测药物在肿瘤部位的递送效率、释放动力学和治疗反应,为个体化治疗评估提供动态的分子图谱。本文综述了SERS技术在乳腺癌转移相关生物标志物检测、肿瘤微环境分析及疗效评估方面的最新进展,并探讨了探针靶向性优化、信号稳定性提高及临床转化的关键挑战。展望未来,随着多模态SERS探针的设计与人工智能数据分析技术的深度融合,SERS技术有望推动乳腺癌诊疗走向精准化和可视化的新阶段。
【关键词】表面增强拉曼光谱 乳腺癌转移 检测 治疗评估
【作者信息】第一作者:王思厶;通讯作者:于法标&王锐&何贵省
乳腺癌转移是临床治疗失败和患者死亡的主要原因,其生物学复杂性和治疗抵抗性使其成为肿瘤研究领域的核心挑战。转移性病变不仅显著缩短患者生存期,还可能引发多器官功能障碍(如骨转移引起的病理性骨折、脑转移导致的神经功能缺损),严重影响患者的生活质量。三阴性乳腺癌(Triple-negative breast cancer,TNBC)是最具侵袭性的亚型,约占乳腺癌病例的15%~20%,易形成远端器官转移。乳腺癌的转移通常意味着预后不良,尽管早期乳腺癌的五年生存率超过90%,一旦发展为转移性乳腺癌(Metastatic breast cancer,MBC),其五年生存率急剧下降至约30%,且TNBC的预后尤为不良。因此,有效控制乳腺癌转移对于提高患者生存率至关重要。乳腺癌的诊断和治疗近年来取得了显著进展,但其治疗复杂性和患者预后问题仍是重大挑战。尽管目前已有多种成像技术和分子标志物用于乳腺癌的诊断和检测,但MBC的检测仍然存在不足。传统影像技术超声(Ultrasound imaging,US)、计算机断层扫描(Computed tomography,CT)、磁共振成像(Magnetic resonance imaging,MRI)、正电子发射断层显像(Positron emission tomography,PET)、单光子发射计算机断层扫描(Single-photon emission computed tomography,SPECT)、正电子发射断层扫描-CT组合系统(Positron emission tomography-computed tomography,PET-CT)能够定位转移灶,但其灵敏度和特异性有限,尤其在检测微小转移灶时存在明显局限。组织病理学活检被视为肿瘤诊断的“金标准”,但其侵入性操作以及肿瘤异质性(原发灶与转移灶的分子特征差异可达40%)使其难以动态反映转移过程。尽管液体活检可检测循环肿瘤细胞(Circulating tumor cells,CTCs)和外泌体(Exosomes,exos),但这些标志物在乳腺癌转移中的敏感性和稳定性仍需进一步临床验证。在MBC的治疗中,面临多重挑战。首先,解剖屏障(如血脑屏障)和肿瘤微环境(如低氧、酸性pH))显著降低了化疗药物(如紫杉醇、蒽环类)的递送效率。其次,免疫抑制微环境(如PD-L1高表达、调节性T细胞浸润)削弱了免疫检查点抑制剂(如阿替利珠单抗)的疗效,特别是TNBC患者对单药免疫治疗的客观缓解率不足15%。此外,肿瘤干细胞(Cancer stem cells,CSCs)的耐药性和休眠状态导致治疗后的早期复发,约60%的转移性乳腺癌患者在治疗一年内出现疾病进展。虽然新型疗法(如抗体-药物偶联物T-DXd、PARP抑制剂奥拉帕利)在某些亚群中显示了潜力,但疗效仍受到生物标志物选择和获得性耐药机制的限制。因此,发展针对乳腺癌转移机制的研究和创新检测技术具有迫切的临床需求。SERS技术凭借其高灵敏度、非侵入性和多靶标检测能力,成为乳腺癌转移检测的重要工具。SERS能够有效示踪微小转移灶并指导个体化治疗,同时弥补现有技术的不足,为乳腺癌转移的早期诊断和治疗评估提供新的解决方案。
2 SERS概述和探针设计优化
拉曼散射(Raman scattering,RS)是一种基于分子振动特征的光谱分析技术。其原理是入射光与分子相互作用后,光子的能量发生微小变化,导致散射光的频率偏移,这一频移与分子振动模式相关。因此,拉曼光谱能够提供分子结构的指纹信息,广泛应用于化学、生物和材料科学等领域。然而,普通拉曼散射的散射截面极小,仅约为入射光的10-6~10-8,导致其信号极其微弱。此外,背景荧光干扰和低检测灵敏度限制了拉曼技术在痕量分析中的应用。1974年,Fleischmann等在粗糙的银电极表面观察到异常增强的吡啶分子信号,1977年Van Duyne和Jeanmaire等揭示其核心机理源于贵金属纳米结构的局域电磁场增强,并正式提出表面增强拉曼(Surface-enhanced Raman scattering,SERS)概念。随着激光技术和纳米材料与技术的发展,逐步明确了电磁场增强与化学增强的协同机制,并优化金、银等基底材料,奠定了单分子检测的理论基础。21世纪以来,纳米技术的突破推动了SERS的快速发展。通过精密调控纳米结构(如核壳、纳米间隙阵列)产生“热点”,灵敏度显著提升,应用扩展至生物医学、环境监测和公共安全。当前研究聚焦非贵金属基底、智能响应材料及单分子检测优化,同时探索与微流控、机器学习的多模态集成。未来,SERS有望在精准医疗、实时环境监测等领域实现更广泛的实际应用,其理论完善与技术创新将持续驱动分析科学的进步。纳米材料的引入是SERS技术发展的关键。纳米材料,尤其是贵金属纳米结构(如银和金)以及二维纳米材料(如石墨烯),在多种疾病诊断中展现出巨大的潜力。如图1所示,基于SERS的疾病检测方法备受关注。拉曼信号可以在纳米材料的作用下增强几个数量级(通常是103~108倍)。当分子吸附到特定结构表面(如贵金属纳米结构)时,拉曼信号会通过两种机制显著增强,电磁场增强和化学增强 。电磁场增强通常发生在贵金属纳米结构表面,源于局部表面等离子体共振(Localized surface plasmon resonance, LSPR)的激发(图1A)。当入射光与金属纳米颗粒相互作用时,其表面的自由电子发生集体振荡,从而在纳米结构附近产生强电磁场。这种局部电磁场的增强效应能够显著提高拉曼信号的强度。LSPR现象可被从紫外至可见光波段的电磁波激发,是贵金属纳米结构SERS增强的关键机制。然而,这种增强机制不适用于大多数半导体纳米材料,因为它们通常不具备产生LSPR所需的自由电子密度。化学增强机制是半导体纳米材料中SERS信号增强的主要来源(图1B)。该机制依赖于分子与基底之间的电子耦合,具体受材料的能级结构和电子态密度的影响,包括带隙能量、最高占据分子轨道和最低未占据分子轨道的位置。当分子吸附在半导体表面时,可能发生电荷转移过程,从而增强拉曼散射信号。尽管化学增强的效应通常较电磁增强弱几个数量级,但其选择性更高,适用于某些无法通过LSPR增强的分子系统。光催化剂的激发指的是光催化剂吸收能量大于或等于其禁带宽度的光子能量后,内部电子被激发至高能级状态的过程,是光催化反应中的关键步骤。被激发的电子从价带跃迁到导带,在价带上会留下相对稳定的空穴,形成电子-空穴对。激发态的电子和空穴需要分离并传输到光催化剂的表面或活性位点,以便与反应物发生氧化还原反应。导带上处于激发态的电子具有较高的能量和移动性,可以参与还原反应;价带上的空穴带正电,可以参与氧化反应。光照强度和波长、催化剂的能带结构、催化剂的表面结构和形貌、催化剂的掺杂或修饰以及反应环境是影响光催化过程中催化剂效率和活性的主要因素。通常情况下:光照强度越高、波长与催化剂吸收波长匹配度越好,催化剂吸收光子的概率就越大,则电子-空穴对的激发效率越高;催化剂的能带结构决定了其能否有效地吸收和利用光子;表面结构和形貌会影响光子的吸收强度、电子-空穴对的分离效率以及活性位点的暴露程度;通过掺杂或表面修饰,可以调节催化剂的电子结构、能带位置和光吸收特性,从而改善其光催化性能;反应体系的温度、pH值、反应物浓度和溶液中的氧含量等因素会影响催化剂表面的电荷转移过程和催化活性,进而影响光催化反应的进行。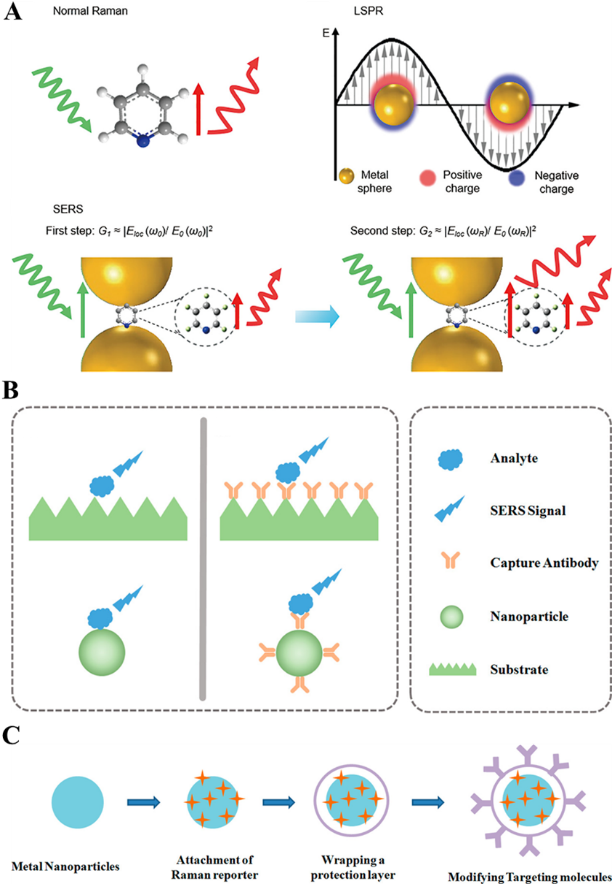 图1 (A)SERS中常规拉曼、局域表面等离子体共振(LSPR)和电磁增强机制的示意图;(B) 无标记SERS检测原理:吸附介导的无标记SERS检测和抗体/配体介导的无标记SERS检测;(C) 典型SERS探针的制备流程SERS能够实现单分子检测在很大程度上是由于吸附在纳米结构金属上,如金或银纳米颗粒表面的那些分子对非弹性光散射的增强(106~108)。与其他高灵敏度技术相比,SERS检测无需复杂的样品制备程序,减少了前处理步骤。总体而言,SERS正迅速成为在生物分析、疾病检测和诊断中成功应用的重要分析技术。此外,生物相容的SERS活性纳米颗粒或底物可以涂覆适当的表面活性剂或保护壳,以提高其在生物环境中的稳定性。这些纳米颗粒或底物可以用于直接检测或通过特定受体、适体等实现间接检测,从而实现对生物分析物的高效识别。无论是直接检测还是间接检测,SERS技术都表现出高精度和卓越的灵敏度,能够为乳腺癌转移的早期诊断和治疗评估提供可靠的检测手段。SERS技术包括直接检测和间接检测两种方法。直接检测是指通过分析目标分子的固有拉曼指纹信号来识别目标分子,无需任何外部信号标记(图1B) 。这种方法具有较强的吸引力,尤其在单分子层面的高灵敏度检测中表现突出,因为它能够直接获取目标分子的独特信息,避免了传统方法中可能引入的干扰或误差。然而,其实际应用受限于两个关键问题:一是大多数生物分子本身的拉曼散射截面较小,信号微弱。二是在生物体系中,纳米探针表面易被血清蛋白吸附形成“蛋白质冠”,该结构不仅屏蔽活性位点,还会显著削弱SERS信号强度,降低选择性,并影响体内循环稳定性。相比之下,间接SERS检测能在一定程度上克服直接检测的不足。该方法通常利用各种有机分子作为拉曼报告分子修饰在贵金属纳米颗粒表面,并在其外层包覆保护壳,同时连接特异性的靶向配体,从而实现对蛋白质、DNA及其他生物标志物的间接检测(图1C)。在间接SERS检测中,通过将靶向部分连接到纳米材料上,然后将SERS标签结合到分子靶标上并通过报告分子的拉曼信号来识别靶标。与自发拉曼散射相比,SERS信号在纳米尺度上的显著增强,使其能够检测到极低浓度甚至是单分子级别的生物分子。通过在SERS探针表面修饰靶向单元(如单克隆抗体、小分子配体或特异性肽链),可以实现对乳腺癌相关分子,如人类表皮生长因子受体2型(Human epidermal growth factor receptor 2,HER2)、表皮生长因子受体(Epidermal growth factor receptor,EGFR)以及黏蛋白1(mucin 1,MUC1)的特异性识别。靶向单元与肿瘤细胞表面受体高度亲和结合,有效提升信号的选择性,从而降低背景干扰。这种策略不仅增强了检测的可靠性,也有助于区分肿瘤细胞亚群,为肿瘤异质性分析提供数据支持。SERS技术可与其他临床影像手段和分子影像技术整合,实现多模态成像。SERS在分子层面提供高分辨率、指纹特征的信息,而其他成像技术则具备宏观结构显示或解剖定位功能。多模态融合不仅提升了成像的准确性与空间分辨率,还可用于乳腺癌病灶的多维度可视化,如检测肿瘤的确切位置、边界清晰度及潜在转移灶。SERS与荧光成像、MRI等联用,可同步实现微观检测与宏观观察,为精准诊断提供更可靠的依据。在乳腺癌转移的实时监测中,SERS具备较高的检测灵敏度和快速响应能力,能够在不需复杂样本前处理的前提下,实现对微量CTCs、Exos的直接检测。其窄峰宽、低背景干扰的光谱特性,使其能够精确区分结构相似的生物分子,克服传统荧光检测存在的光谱重叠问题。此外,与苏木精-伊红染色(Hematoxylin-eosin staining,HE染色)、免疫组织化学(Immunohistochemistry,IHC)聚合酶链式反应(Polymerase chain reaction,PCR)等常规方法相比,SERS可实现即时光谱获取,大幅提升检测效率,尤其适用于术中快速评估和病程动态监测。乳腺癌是一种具有高度分子异质性和易转移特征的恶性肿瘤,不同患者、甚至同一患者体内不同部位的肿瘤细胞,往往存在显著的分子表达差异。例如,HER2、雌激素受体(Estrogen receptor,ER)、孕激素受体(Progesterone receptor,PR)等标志物的表达水平可因细胞亚群的异质性或肿瘤微环境的变化而发生下调或缺失。这种情况容易导致单一标志物检测出现漏检,从而影响疾病的准确诊断与治疗决策。SERS探针通过设计多靶点识别平台,能够同时携带多个拉曼报告分子,靶向不同的分子标志物。这种多重检测策略可显著提升对乳腺癌相关生物信号的捕获能力,提高检测的灵敏度和特异性,有效降低假阴性率。例如,同时识别HER2、EGFR以及MUC1等,可涵盖更广泛的乳腺癌亚型,从而弥补单一标志物可能遗漏的病灶信息。从临床角度来看,识别多个分子标志物不仅有助于精准定位微小或隐匿的转移灶,还可用于评估肿瘤的侵袭性和耐药性,为制定个性化治疗方案提供重要依据,特别是在术前分型、术中导航及术后疗效追踪等环节,多靶标检测能够为临床提供更全面、动态的疾病信息,辅助医生实现更早期、更准确的干预。此外,多标志物策略也适用于监测治疗相关生物变化,例如肿瘤微环境中免疫细胞浸润、上皮-间质转化(Epithelial-mesenchymal transition,EMT)过程的标志物变化等,为抗药机制研究及新靶点筛选提供了强有力的技术支持。因此,基于SERS的多靶标检测平台不仅是应对乳腺癌分子复杂性的有效手段,也为推进精准医学提供了可行的解决方案。为进一步提高乳腺癌诊断的效率与准确性,SERS平台正逐步与多种先进技术实现融合,推动其向智能化、集成化方向发展。这种跨技术整合不仅增强了检测的多维度能力,也赋予了SERS更强的应用灵活性,满足复杂临床场景下的多样化需求。首先,微流控芯片技术的引入实现了样本处理流程的自动化与高通量操作。其微型化结构可精准操控液体流动,使样本从预处理、混合到反应均在微通道中完成,大大减少了人工操作误差与样本损耗,同时显著提升了检测效率。这种集成系统特别适合液体活检和术中快速检测等需要快速响应的场景。其次,人工智能(Artificial intelligence,AI)算法,特别是深度学习和模式识别技术,在SERS光谱的信号解析中发挥着越来越重要的作用。通过训练模型识别不同生物标志物的拉曼特征峰,AI可有效提高信号识别的准确率,尤其在信号微弱或背景复杂的样本中更具优势。免疫分析技术与SERS结合形成免疫SERS平台,可通过抗体-抗原特异性识别,实现对乳腺癌相关蛋白的高灵敏检测。相比传统免疫染色,SERS可提供更快、定量化的结果。在基因层面,SERS探针能够靶向识别癌症相关的突变位点,如PIK3CA(Phosphoinositide-3-kinase catalytic subunit alpha)、乳腺癌易感基因1(Breast cancer 1,BRCA1)等。利用功能化的核酸探针修饰在SERS基底上,不仅提升了特异性,还能在无需PCR扩增的情况下直接获取突变信息,为早期分子诊断提供技术保障。最后,智能纳米探针的应用拓展了SERS在代谢检测中的能力。通过在探针表面加载pH响应单元、酶或靶向分子,这些纳米结构可实现乳酸、葡萄糖、谷胱甘肽等代谢物的实时监测,助力肿瘤代谢状态评估与疗效动态追踪。综合来看,SERS平台与这些前沿技术的融合不仅拓宽了其在乳腺癌筛查、术中导航、疗效评估和个性化治疗等多环节的应用场景,也提升了操作的灵活性与系统的可扩展性。临床上医生可以根据临床需求灵活选取检测模式,实现从分子水平到系统层面的多维度信息整合,为精准医疗提供更强有力的支持。SERS探针的核心在于基底材料与结构的优化,其性能直接决定了SERS信号的增强效率、稳定性和检测灵敏度。传统SERS基底以贵金属材料为主,因其表面等离子体共振效应可在纳米尺度内产生极强的局域电磁场。早期研究通过制备胶体纳米颗粒实现信号的增强,但随机分布的纳米结构导致信号重现性较差。随着纳米材料与技术的发展,基底设计趋向精细化:通过电子束光刻、纳米压印和自组装技术制备周期性纳米阵列、核壳结构及纳米间隙的“热点”结构,可大幅提升电磁场强度。如图2所示,金纳米二聚体或纳米星因其间隙耦合和尖端效应,可产生高达109~1010倍的信号增强,有望实现单分子水平的检测。此外,非贵金属基底(过渡金属氧化物、二维材料MoS2、石墨烯等)因其独特的电荷转移机制和化学稳定性受到广泛关注,尤其在高温或腐蚀性环境下具有稳定的信号输出。近年来,复合基底(金属-半导体异质结等)通过协同电磁增强与化学增强,进一步拓宽了SERS探针的应用场景与范围。
图1 (A)SERS中常规拉曼、局域表面等离子体共振(LSPR)和电磁增强机制的示意图;(B) 无标记SERS检测原理:吸附介导的无标记SERS检测和抗体/配体介导的无标记SERS检测;(C) 典型SERS探针的制备流程SERS能够实现单分子检测在很大程度上是由于吸附在纳米结构金属上,如金或银纳米颗粒表面的那些分子对非弹性光散射的增强(106~108)。与其他高灵敏度技术相比,SERS检测无需复杂的样品制备程序,减少了前处理步骤。总体而言,SERS正迅速成为在生物分析、疾病检测和诊断中成功应用的重要分析技术。此外,生物相容的SERS活性纳米颗粒或底物可以涂覆适当的表面活性剂或保护壳,以提高其在生物环境中的稳定性。这些纳米颗粒或底物可以用于直接检测或通过特定受体、适体等实现间接检测,从而实现对生物分析物的高效识别。无论是直接检测还是间接检测,SERS技术都表现出高精度和卓越的灵敏度,能够为乳腺癌转移的早期诊断和治疗评估提供可靠的检测手段。SERS技术包括直接检测和间接检测两种方法。直接检测是指通过分析目标分子的固有拉曼指纹信号来识别目标分子,无需任何外部信号标记(图1B) 。这种方法具有较强的吸引力,尤其在单分子层面的高灵敏度检测中表现突出,因为它能够直接获取目标分子的独特信息,避免了传统方法中可能引入的干扰或误差。然而,其实际应用受限于两个关键问题:一是大多数生物分子本身的拉曼散射截面较小,信号微弱。二是在生物体系中,纳米探针表面易被血清蛋白吸附形成“蛋白质冠”,该结构不仅屏蔽活性位点,还会显著削弱SERS信号强度,降低选择性,并影响体内循环稳定性。相比之下,间接SERS检测能在一定程度上克服直接检测的不足。该方法通常利用各种有机分子作为拉曼报告分子修饰在贵金属纳米颗粒表面,并在其外层包覆保护壳,同时连接特异性的靶向配体,从而实现对蛋白质、DNA及其他生物标志物的间接检测(图1C)。在间接SERS检测中,通过将靶向部分连接到纳米材料上,然后将SERS标签结合到分子靶标上并通过报告分子的拉曼信号来识别靶标。与自发拉曼散射相比,SERS信号在纳米尺度上的显著增强,使其能够检测到极低浓度甚至是单分子级别的生物分子。通过在SERS探针表面修饰靶向单元(如单克隆抗体、小分子配体或特异性肽链),可以实现对乳腺癌相关分子,如人类表皮生长因子受体2型(Human epidermal growth factor receptor 2,HER2)、表皮生长因子受体(Epidermal growth factor receptor,EGFR)以及黏蛋白1(mucin 1,MUC1)的特异性识别。靶向单元与肿瘤细胞表面受体高度亲和结合,有效提升信号的选择性,从而降低背景干扰。这种策略不仅增强了检测的可靠性,也有助于区分肿瘤细胞亚群,为肿瘤异质性分析提供数据支持。SERS技术可与其他临床影像手段和分子影像技术整合,实现多模态成像。SERS在分子层面提供高分辨率、指纹特征的信息,而其他成像技术则具备宏观结构显示或解剖定位功能。多模态融合不仅提升了成像的准确性与空间分辨率,还可用于乳腺癌病灶的多维度可视化,如检测肿瘤的确切位置、边界清晰度及潜在转移灶。SERS与荧光成像、MRI等联用,可同步实现微观检测与宏观观察,为精准诊断提供更可靠的依据。在乳腺癌转移的实时监测中,SERS具备较高的检测灵敏度和快速响应能力,能够在不需复杂样本前处理的前提下,实现对微量CTCs、Exos的直接检测。其窄峰宽、低背景干扰的光谱特性,使其能够精确区分结构相似的生物分子,克服传统荧光检测存在的光谱重叠问题。此外,与苏木精-伊红染色(Hematoxylin-eosin staining,HE染色)、免疫组织化学(Immunohistochemistry,IHC)聚合酶链式反应(Polymerase chain reaction,PCR)等常规方法相比,SERS可实现即时光谱获取,大幅提升检测效率,尤其适用于术中快速评估和病程动态监测。乳腺癌是一种具有高度分子异质性和易转移特征的恶性肿瘤,不同患者、甚至同一患者体内不同部位的肿瘤细胞,往往存在显著的分子表达差异。例如,HER2、雌激素受体(Estrogen receptor,ER)、孕激素受体(Progesterone receptor,PR)等标志物的表达水平可因细胞亚群的异质性或肿瘤微环境的变化而发生下调或缺失。这种情况容易导致单一标志物检测出现漏检,从而影响疾病的准确诊断与治疗决策。SERS探针通过设计多靶点识别平台,能够同时携带多个拉曼报告分子,靶向不同的分子标志物。这种多重检测策略可显著提升对乳腺癌相关生物信号的捕获能力,提高检测的灵敏度和特异性,有效降低假阴性率。例如,同时识别HER2、EGFR以及MUC1等,可涵盖更广泛的乳腺癌亚型,从而弥补单一标志物可能遗漏的病灶信息。从临床角度来看,识别多个分子标志物不仅有助于精准定位微小或隐匿的转移灶,还可用于评估肿瘤的侵袭性和耐药性,为制定个性化治疗方案提供重要依据,特别是在术前分型、术中导航及术后疗效追踪等环节,多靶标检测能够为临床提供更全面、动态的疾病信息,辅助医生实现更早期、更准确的干预。此外,多标志物策略也适用于监测治疗相关生物变化,例如肿瘤微环境中免疫细胞浸润、上皮-间质转化(Epithelial-mesenchymal transition,EMT)过程的标志物变化等,为抗药机制研究及新靶点筛选提供了强有力的技术支持。因此,基于SERS的多靶标检测平台不仅是应对乳腺癌分子复杂性的有效手段,也为推进精准医学提供了可行的解决方案。为进一步提高乳腺癌诊断的效率与准确性,SERS平台正逐步与多种先进技术实现融合,推动其向智能化、集成化方向发展。这种跨技术整合不仅增强了检测的多维度能力,也赋予了SERS更强的应用灵活性,满足复杂临床场景下的多样化需求。首先,微流控芯片技术的引入实现了样本处理流程的自动化与高通量操作。其微型化结构可精准操控液体流动,使样本从预处理、混合到反应均在微通道中完成,大大减少了人工操作误差与样本损耗,同时显著提升了检测效率。这种集成系统特别适合液体活检和术中快速检测等需要快速响应的场景。其次,人工智能(Artificial intelligence,AI)算法,特别是深度学习和模式识别技术,在SERS光谱的信号解析中发挥着越来越重要的作用。通过训练模型识别不同生物标志物的拉曼特征峰,AI可有效提高信号识别的准确率,尤其在信号微弱或背景复杂的样本中更具优势。免疫分析技术与SERS结合形成免疫SERS平台,可通过抗体-抗原特异性识别,实现对乳腺癌相关蛋白的高灵敏检测。相比传统免疫染色,SERS可提供更快、定量化的结果。在基因层面,SERS探针能够靶向识别癌症相关的突变位点,如PIK3CA(Phosphoinositide-3-kinase catalytic subunit alpha)、乳腺癌易感基因1(Breast cancer 1,BRCA1)等。利用功能化的核酸探针修饰在SERS基底上,不仅提升了特异性,还能在无需PCR扩增的情况下直接获取突变信息,为早期分子诊断提供技术保障。最后,智能纳米探针的应用拓展了SERS在代谢检测中的能力。通过在探针表面加载pH响应单元、酶或靶向分子,这些纳米结构可实现乳酸、葡萄糖、谷胱甘肽等代谢物的实时监测,助力肿瘤代谢状态评估与疗效动态追踪。综合来看,SERS平台与这些前沿技术的融合不仅拓宽了其在乳腺癌筛查、术中导航、疗效评估和个性化治疗等多环节的应用场景,也提升了操作的灵活性与系统的可扩展性。临床上医生可以根据临床需求灵活选取检测模式,实现从分子水平到系统层面的多维度信息整合,为精准医疗提供更强有力的支持。SERS探针的核心在于基底材料与结构的优化,其性能直接决定了SERS信号的增强效率、稳定性和检测灵敏度。传统SERS基底以贵金属材料为主,因其表面等离子体共振效应可在纳米尺度内产生极强的局域电磁场。早期研究通过制备胶体纳米颗粒实现信号的增强,但随机分布的纳米结构导致信号重现性较差。随着纳米材料与技术的发展,基底设计趋向精细化:通过电子束光刻、纳米压印和自组装技术制备周期性纳米阵列、核壳结构及纳米间隙的“热点”结构,可大幅提升电磁场强度。如图2所示,金纳米二聚体或纳米星因其间隙耦合和尖端效应,可产生高达109~1010倍的信号增强,有望实现单分子水平的检测。此外,非贵金属基底(过渡金属氧化物、二维材料MoS2、石墨烯等)因其独特的电荷转移机制和化学稳定性受到广泛关注,尤其在高温或腐蚀性环境下具有稳定的信号输出。近年来,复合基底(金属-半导体异质结等)通过协同电磁增强与化学增强,进一步拓宽了SERS探针的应用场景与范围。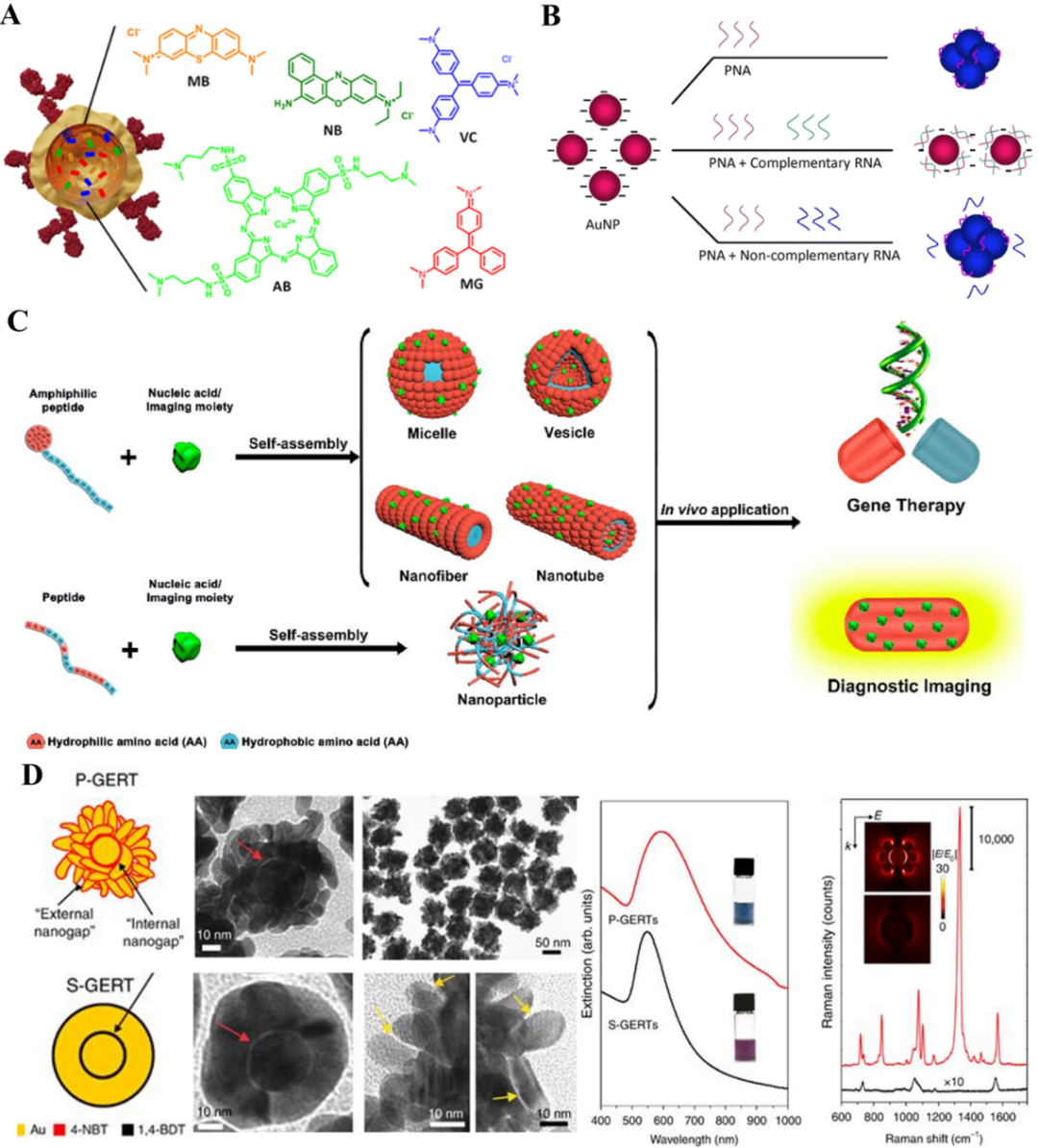 图2SERS探针结合基底和拉曼报告分子: (A) 拉曼报告分子;(B) 使用AuNP比色检测分析的RNA检测方法;(C) 肽和氨基酸如何使金纳米颗粒功能化;(D) 金纳米粒子的能隙增强尽管SERS基底性能显著提升,其大规模应用仍面临制备复杂、均一性控制困难及信号一致性差等挑战。贵金属纳米材料虽然灵敏,但易氧化或团聚,需要进行额外修饰才能在复杂环境下发挥作用。为此,研究人员提出多种解决方案:(1)通过在基底表面包覆二氧化硅或高分子层对其进行仿生化修饰提高稳定性和生物相容性;(2)将金属纳米结构负载至聚合物或纤维膜上制备柔性基底从而适应曲面或柔性器件的原位检测;(3)利用光热或pH敏感材料动态调控“热点”分布,实现按需增强。此外,3D多孔基底通过增加分子吸附位点,能显著提升检测通量。SERS探针通过将拉曼报告分子固定在贵金属纳米颗粒表面,能够实现对生物分子的高灵敏检测。常用的拉曼报告分子通常具备以下结构特征。首先,它们应具有较高的拉曼散射截面(如罗丹明、亚甲基蓝),能够显著增强信号强度;其次,含有特定官能团(如4-巯基苯甲酸、巯基吡啶、巯基嘧啶),使其能够牢固吸附在贵金属纳米颗粒表面;此外,具备共轭电子体系(如四甲基罗丹明、结晶紫),可提高极化率变化并增强拉曼信号;最后,这些分子具有良好的稳定性,不易降解(如偶氮染料、三苯基甲烷染料),从而保证信号的可靠性。在SERS探针的应用中,这些拉曼报告分子被固定在贵金属纳米颗粒表面,并结合保护壳上的靶向配体,实现对生物分子(如蛋白质、DNA等)的高灵敏度检测。为了确保SERS探针能够高效识别乳腺癌细胞,设计时需要针对特定的分子标志物进行功能化修饰。通过将抗体、肽链或其他靶向分子修饰到纳米颗粒表面,探针能够精确识别乳腺癌细胞表面特定抗原(如HER2、ER等),从而实现对肿瘤细胞的高效靶向识别。为了增强探针的信号强度,探针设计时需选择合适的粒径、形状(如纳米球、纳米棒、纳米星等)以及金属材料(如金、银),并优化金属纳米颗粒的LSPR效应,从而增强信号。此外,探针表面的保护层或功能化修饰可防止在体内环境中金属纳米颗粒发生氧化或聚集,从而维持其稳定性。在具体修饰方法方面,SERS探针的表面通常会通过聚乙二醇(Polyethylene glycol,PEG)、白蛋白等生物相容材料进行功能化,以降低金属纳米颗粒的毒性和免疫原性。聚合物材料或水溶性物质如PEG常被用于表面修饰,以提高探针的生物相容性,减少其对细胞或组织的负面影响。还可以通过静电吸附或化学共价键将靶向分子与金属纳米颗粒结合。通过这些修饰,探针不仅能提高其生物相容性,还能增强其在乳腺癌细胞识别中的特异性和稳定性。SERS探针的灵敏度在乳腺癌检测中的应用至关重要。为提高灵敏度,通常选择具有较强表面增强效应的纳米材料,并确保其表面有足够的功能基团以增强与目标分子之间的相互作用。通过优化金属纳米颗粒的尺寸、形态和分布,可以进一步提高拉曼信号的强度,进而提升探针的检测灵敏度。
图2SERS探针结合基底和拉曼报告分子: (A) 拉曼报告分子;(B) 使用AuNP比色检测分析的RNA检测方法;(C) 肽和氨基酸如何使金纳米颗粒功能化;(D) 金纳米粒子的能隙增强尽管SERS基底性能显著提升,其大规模应用仍面临制备复杂、均一性控制困难及信号一致性差等挑战。贵金属纳米材料虽然灵敏,但易氧化或团聚,需要进行额外修饰才能在复杂环境下发挥作用。为此,研究人员提出多种解决方案:(1)通过在基底表面包覆二氧化硅或高分子层对其进行仿生化修饰提高稳定性和生物相容性;(2)将金属纳米结构负载至聚合物或纤维膜上制备柔性基底从而适应曲面或柔性器件的原位检测;(3)利用光热或pH敏感材料动态调控“热点”分布,实现按需增强。此外,3D多孔基底通过增加分子吸附位点,能显著提升检测通量。SERS探针通过将拉曼报告分子固定在贵金属纳米颗粒表面,能够实现对生物分子的高灵敏检测。常用的拉曼报告分子通常具备以下结构特征。首先,它们应具有较高的拉曼散射截面(如罗丹明、亚甲基蓝),能够显著增强信号强度;其次,含有特定官能团(如4-巯基苯甲酸、巯基吡啶、巯基嘧啶),使其能够牢固吸附在贵金属纳米颗粒表面;此外,具备共轭电子体系(如四甲基罗丹明、结晶紫),可提高极化率变化并增强拉曼信号;最后,这些分子具有良好的稳定性,不易降解(如偶氮染料、三苯基甲烷染料),从而保证信号的可靠性。在SERS探针的应用中,这些拉曼报告分子被固定在贵金属纳米颗粒表面,并结合保护壳上的靶向配体,实现对生物分子(如蛋白质、DNA等)的高灵敏度检测。为了确保SERS探针能够高效识别乳腺癌细胞,设计时需要针对特定的分子标志物进行功能化修饰。通过将抗体、肽链或其他靶向分子修饰到纳米颗粒表面,探针能够精确识别乳腺癌细胞表面特定抗原(如HER2、ER等),从而实现对肿瘤细胞的高效靶向识别。为了增强探针的信号强度,探针设计时需选择合适的粒径、形状(如纳米球、纳米棒、纳米星等)以及金属材料(如金、银),并优化金属纳米颗粒的LSPR效应,从而增强信号。此外,探针表面的保护层或功能化修饰可防止在体内环境中金属纳米颗粒发生氧化或聚集,从而维持其稳定性。在具体修饰方法方面,SERS探针的表面通常会通过聚乙二醇(Polyethylene glycol,PEG)、白蛋白等生物相容材料进行功能化,以降低金属纳米颗粒的毒性和免疫原性。聚合物材料或水溶性物质如PEG常被用于表面修饰,以提高探针的生物相容性,减少其对细胞或组织的负面影响。还可以通过静电吸附或化学共价键将靶向分子与金属纳米颗粒结合。通过这些修饰,探针不仅能提高其生物相容性,还能增强其在乳腺癌细胞识别中的特异性和稳定性。SERS探针的灵敏度在乳腺癌检测中的应用至关重要。为提高灵敏度,通常选择具有较强表面增强效应的纳米材料,并确保其表面有足够的功能基团以增强与目标分子之间的相互作用。通过优化金属纳米颗粒的尺寸、形态和分布,可以进一步提高拉曼信号的强度,进而提升探针的检测灵敏度。
3 基于SERS技术的乳腺癌转移检测及筛查
SERS技术由于其高灵敏度和高时空分辨,在乳腺癌转移检测和治疗评估中展现了巨大的潜力。SERS技术可通过液体活检,高灵敏检测CTCs、EXOs等转移性标志物,提供无创且高效的转移监测手段。同时,SERS成像技术能够精准定位微小的转移病灶,改善乳腺癌的早期诊断和手术定位。在乳腺癌组织病理学活检中,SERS技术通过直接分析组织中的分子信息,提供比传统组织学方法更为迅速和准确的诊断结果,避免了染色和免疫组化过程中的人为误差。这些优势使SERS技术在乳腺癌转移检测及个性化治疗评估中具有重要应用前景。
液体活检作为一种无创性诊断技术,通过分析肿瘤来源的物质,如CTCs、EXOs、微小核糖核酸(MicroRNA,miRNA),具有早期诊断和动态监测的优势。液体活检能够克服乳腺癌肿瘤细胞的异质性,全面反映肿瘤组织的生化信息,为乳腺癌的早期诊断、治疗监测和手术评估提供了可靠的支持。上皮-间质转化(Epithelial-mesenchymal transition, EMT)是促进乳腺癌转移的关键机制,其通过促进CTCs从原发灶脱落、增强迁移侵袭能力、提高循环存活率、促进远端定植,增强CTCs的转移潜能。组织病理活检是当前EMT监测金标准,但SERS技术因其非侵入性和高灵敏度展现出替代潜力。基于CTCs表型特征及EMT动态过程的监测策略。EMT过程中,肿瘤细胞从上皮表型逐渐转化为间充质表型,这一转化使肿瘤细胞从原发灶脱离,侵入血管系统形成CTCs,进而通过血流播散至远端器官(图3A)。为实时监测CTCs的表型异质性,研究人员开发了一种SERS的多重纳米探针标记技术(图3B)。该技术利用四种金纳米探针分别靶向上皮标志物(EpCAM,1338 cm-¹)、E-钙黏蛋白(E-cadherin,1080 cm-¹)、N-钙黏蛋白(N-cadherin,1379 cm-¹)和肿瘤干细胞标志物(ABCB5,1000 cm-¹)。通过SERS光谱分析(图3C(i)),我们能够同时检测不同CTCs亚群的表型特征。结合多重标记策略(图3C(ii)),可实现对CTCs群体的精准分型。此外,由于SERS信号强度与标志物表达水平呈正相关,我们进一步构建了CTCs表型异质性分析模型(图3C(iii))。在该模型中,信号强度的分布宽度直接反映CTCs群体的异质性程度。分布范围越宽,拉曼信号分布特征可定量表征CTCs的异质性,信号分布宽度与CTCs表型多样性呈正相关。该技术通过同步检测上皮标志物、E-钙黏蛋白等EMT标志物,为乳腺癌转移预警和治疗反应监测(新辅助化疗后异质性降低)提供了新型分子工具。外泌体是一类由细胞分泌的纳米级囊泡,广泛存在于各种体液中,作为细胞间信息传递的重要媒介,能够携带多种生物活性分子,如蛋白质、脂质、DNA和多种类型的RNA(包括miRNA和lncRNA)。近年来研究表明,肿瘤来源外泌体在乳腺癌的发生、发展、转移及治疗反应中发挥着关键作用。它们不仅参与调控肿瘤微环境、促进血管生成和免疫逃逸,还可通过与靶细胞相互作用改变其生物学行为。由于外泌体分子组成与肿瘤状态密切相关,因此被视为一种具有巨大潜力的无创生物标志物,能够用于乳腺癌的早期诊断、预后判断以及疗效监测。如图3D(i, ii)所示,SK人乳腺癌细胞3系(SK breast cancer 3,SKBR3)和密歇根癌症基金会-7细胞(Michigan cancer foundation-7,MCF)来源的外泌体分别与HER2和MUC1适体探针孵育的示意过程。通过使用高浓度等摩尔比的适配体探针,实现对靶标分子的饱和识别。通过多元曲线分辨-交替最小二乘法(MCR-ALS)对单外泌体SERS光谱进行解析,成功解卷积获得两个特征端元光谱,分别对应HER2特征谱(α系数,主要峰位:1580 cm⁻¹)、MUC1特征谱(β系数,特征峰:1120 cm⁻¹)。各外泌体中α/β比值可定量反映HER2与MUC1的相对表达水平,为乳腺癌分子分型提供单囊泡水平的多参数分析(图3D(iii))。SKBR-EXOs与MCF-EXOs的平均强度比值(α/β)统计分布图,显示出两者在表面标志物表达方面存在显著差异(图3E)。该结果与蛋白质免疫印迹(Western blotting,WB)检测HER2/MUC1表达比值高度一致,从侧面验证了解混模型的可靠性。SERS光谱重构证实HER2/MUC1信号加权可精确解析EXOs表面标志物(图3F)。这一模型展示了基于SERS的单外泌体分析全流程技术路线,实现了从外泌体捕获到分子表型解析的一体化分析。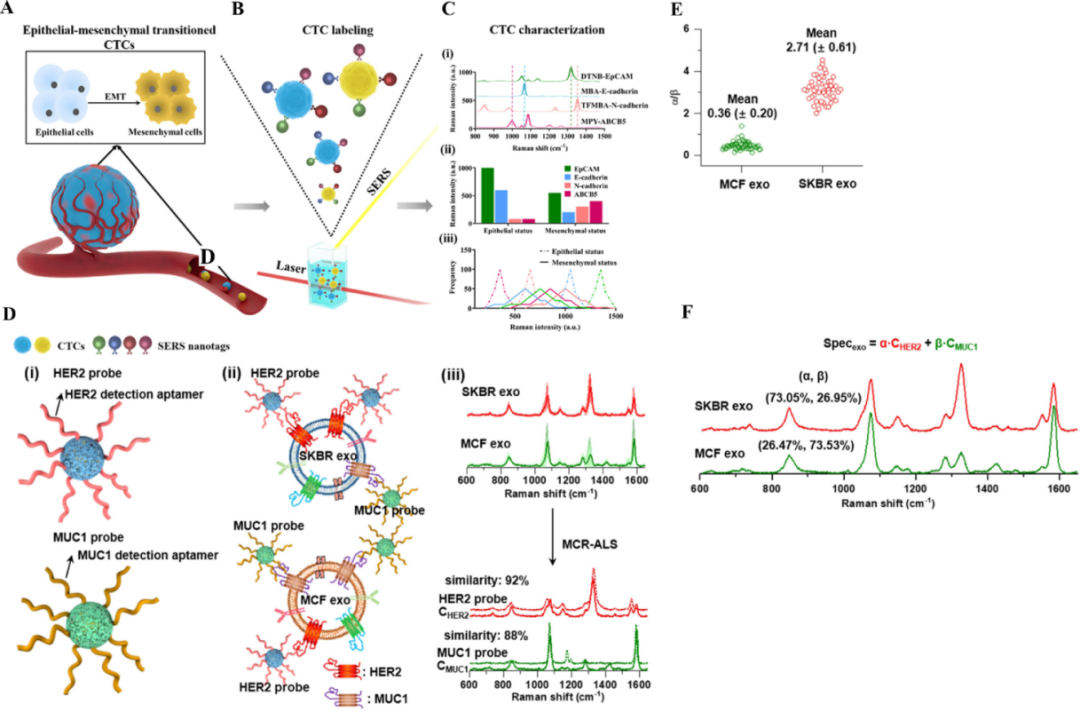 图3通过表征循环肿瘤细胞表型及其异质性的动态演变追踪上皮-间充质转化过程,其中SERS光谱信号分布曲线的展宽程度与异质性水平呈正相关,同时该技术也可用于单个外泌体的SERS光谱构建:(A) 上皮-间质转化(EMT)过程同时发生于肿瘤原发灶和循环系统,当肿瘤细胞/循环肿瘤细胞(CTCs)暴露于TGF-β等EMT诱导因子时,会导致细胞表型和形态发生从上皮型向间质型的转变;(B) 通过功能化SERS纳米标签标记CTCs后,在激光激发下进行检测;(C) (i) 功能化SERS纳米标签的特征峰分别位于:DTNB (1338 cm⁻¹)、MBA (1080 cm⁻¹)、TFMBA (1379 cm⁻¹)和MPY (1000 cm⁻¹);(ii) 标志物特异性SERS纳米标签的特征峰强度可显示CTCs在上皮状态和间质状态下的EMT相关表型;(iii) 信号分布曲线反映了CTCs在上皮和间质状态下的表型异质性;(D) (i) HER2和MUC1探针的结构示意图;(ii) 探针与外泌体表面HER2和MUC1的特异性结合;(iii) 通过多元曲线分辨-交替最小二乘法(MCR-ALS)将SKBR和MCF细胞来源外泌体的复杂SERS光谱解析为两个组分光谱(CHER2和CMUC1),它们分别与HER2和MUC1探针的SERS光谱高度相似; (E) 经MCR-ALS解析得到的相对SERS强度比(α/β)在SKBR外泌体(n=50)和MCF外泌体(n=50)中的分布情况;(F) 单个SKBR和MCF外泌体的复合SERS光谱(Specexo)可通过两个结合探针SERS光谱的加权求和构建:Specexo = α·CHER2 + β·CMUC1,其中α和β分别代表相应外泌体中HER2和MUC1蛋白标志物的权重(丰度)微小核糖核酸是一类内源性非编码RNA,在调控基因表达、细胞增殖、浸润和迁移等过程中扮演关键角色,其异常表达与乳腺癌的发生和转移密切相关。已有研究指出,ER-/PR-型乳腺癌患者血清中微小RNA-21(microRNA-21,miR-21)、微小RNA-106a(microRNA-106a,miR-106a)和微小RNA-155(microRNA-155,miR-155)显著上调,而微小RNA-126(microRNA-126,miR-126)、微小RNA-199a(microRNA-199a,miR-199a)和微小RNA-335(microRNA-335,miR-335)显著下调,提示miRNAs在乳腺癌分子分型与治疗评估中具有潜在的生物标志物价值。目前主流miRNA检测技术包括Northern印迹杂交(Northern blotting,Northern blot)、实时荧光定量逆转录聚合酶链式反应(Reverse transcription quantitative polymerase chain reaction,RT-qPCR)、次世代测序(Next-generation sequencing,NGS)与微阵列,但它们均存在各自的局限性,如灵敏度不足、耗时较长或标记难度大。因此,亟需一种灵敏度高、操作便捷、可实现高通量分析的新型检测手段。SERS技术因其极高的信号增强能力(增强因子高达1012~1014)和对背景干扰的强耐受性,被认为是实现miRNA精准检测的理想工具。然而,在组织、血清或血浆等复杂临床样本中同时检测多种miRNA仍存在挑战,主要包括:(1)不同miRNA分子的拉曼信号差异细微,难以区分;(2)点对点扫描方式导致整体检测耗时较长。为克服这些限制,研究者提出将SERS与微流控芯片和数字全息成像技术结合,以实现快速、多重、高通量检测。最新研究中开发出一种三维(3D)SERS全息芯片平台,可在9 min内完成乳腺癌相关miRNA的同时定性与定量分析。该系统先通过Exo Ⅲ酶对miRNA进行等温扩增,随后引导扩增产物流入内嵌银纳米颗粒阵列的微流控装置。各miRNA通过打开特异性茎环结构的探针,使荧光染料远离金属基底,造成SERS信号改变。最终通过扫描阵列区域并整合空间-光谱信息,生成可同时识别九种乳腺癌相关miRNA,包括:致死-7b 微小RNA(Lethal-7b microRNA,let-7b)、微小RNA-1(microRNA-1,miR-1)、微小RNA-10b(microRNA-10b,miR-10b)、微小RNA-125b(microRNA-125b ,miR-125b)、miR-126、微小RNA-133a(microRNA-133a,miR-133a)、微小RNA-143(microRNA-143,miR-143)、miR-155、miR-21的3D SERS全息图。该平台最低检测限可达1 aM,在临床样本中表现RT-qPCR约85%的检测一致性,显示出良好的灵敏度与准确性。随着液体活检和无创基准医学理念的发展,SERS在乳腺癌筛查中的应用愈发受到关注。传统乳腺癌筛查方法如乳腺钼靶检查是公认的标准筛查方法,但其在识别早期微小病灶方面存在明显不足,易导致漏诊。此外,乳腺钼靶筛查存在射线暴露风险,不宜频繁检测,且不具备对分子水平异常的识别能力。相比之下,SERS技术具有高灵敏度、高分子特异性和多靶标检测的优势,通过捕捉血清或血浆中的分子指纹特征,为乳腺癌的早期识别提供了新的技术支撑。其次,SERS检测无需复杂的样品前处理或组织采样,仅需少量血液样本即可完成检测,适合广泛的人群筛查。已有研究尝试将SERS谱图与多元统计分析方法(主成分分析PCA、线性判别分析LDA、支持向量机SVM等)结合,建立判别模型,成功区分健康人群与乳腺癌患者的血液样本。这一技术路线具备低成本、高通量、快速响应的优势,为未来基层医疗单位开展无创乳腺癌筛查提供了可行的新工具。除单个癌症类型筛查外,SERS也可用于乳腺癌与其他癌症的鉴别分析。在一项包含253例总血清样本的大规模研究中,研究者收集了来自健康志愿者以及乳腺癌、肺癌、结直肠癌、口腔癌和卵巢癌患者的样本,系统评估了基于SERS光谱的分类准确性。结果显示,SERS技术在不同癌症类型之间的区分中展现出良好的判别能力,提示其在癌症类型特异性筛查与鉴别诊断中的潜在应用价值。术前检测乳腺癌淋巴结转移(Lymph node metastasis, LNM)始终是临床诊疗中的一大难点。为了追踪潜在的转移灶,临床上已广泛应用多种成像技术,包括US、CT、MRI、SPECT以及PET-CT。尽管PET-CT被广泛认为是多种恶性肿瘤影像学检测的“金标准”,其在乳腺癌微小转移灶的识别方面仍面临灵敏度和特异性不足的问题。US检查操作简便、无创、可实时动态成像,常用于评估淋巴结的大小、形态及内部结构。它对深部或体积较小的转移性淋巴结识别能力有限,且对操作人员依赖性强。US的特异性偏低,炎症、感染等良性病变也可能引起淋巴结肿大,导致假阳性率上升,影响诊断准确性。CT在评估解剖结构方面具有较高的空间分辨率,可观察淋巴结大小和钙化情况,但其对微小病灶的分辨能力有限,且主要依赖形态学特征判断,缺乏功能信息,难以准确区分良性和恶性病灶。MRI在软组织成像方面具有出色的对比度,能较好显示乳腺及腋窝区域的解剖细节。MRI成像耗时较长,价格较高,且在微小转移灶尤其是低信号差异病灶的检出方面存在一定局限。SPECT作为功能成像技术,可反映肿瘤组织的代谢和血流情况,用于淋巴引流路径或前哨淋巴结的定位。但其空间分辨率较低,难以明确显示微小结构,且图像易受伪影干扰,不适合精细结构的判断。PET-CT 结合了代谢成像与解剖成像优势,在乳腺癌分期及全身转移评估中应用广泛。尽管其对大体积高代谢病灶具有良好识别能力,但对于低代谢或微小转移灶(尤其是直径< 5 mm的病灶)易漏诊。此外,PET-CT成本高、设备要求高,不适用于常规筛查。传统影像技术在检测乳腺癌微小转移灶方面普遍存在灵敏度不足、特异性有限及空间或代谢分辨率不足等问题。基于形态学判断的方式难以满足早期识别微小转移灶的临床需求,这也促使高灵敏的分子成像技术逐步发展。SERS技术在可视化检测乳腺癌转移病灶中展现出独特优势,尤其在灵敏度、分子特异性及空间分辨率方面表现突出。SERS成像依赖于功能化纳米探针与特定肿瘤相关分子或肿瘤微环境特征(如pH、酶活性)的特异性结合,将拉曼活性分子标记在金属纳米结构表面,通过“热点”效应极大增强信号,实现对微量标志物的可视化追踪。在乳腺癌转移灶检测中,SERS纳米探针可通过主动靶向或被动渗透富集进入转移性淋巴结或远处转移灶。借助拉曼光谱仪,可有效区分转移与非转移组织。相比传统影像模式,SERS能实现对微小转移灶早期、精准的定位和监测,为乳腺癌转移病灶的早期诊断、术中导航及疗效评估提供了强有力的技术支撑。SERS技术凭借其极高的检测灵敏度与分子特异性,有望为乳腺癌转移的早期诊断和精确监测提供全新思路。三阴性乳腺癌作为一种侵袭性极强的乳腺癌亚型,呈现早期转移和不良预后的典型特征,传统检测技术往往缺乏早期检测转移性病变所需的灵敏度和分子特异性。此外,由于缺乏有效的靶向位点,抗体、多肽和适配体等识别单元难以特异性靶向到肿瘤细胞并实时追踪肿瘤转移。为克服以上不足,开发基于SERS和生物发光的双模态成像策略结合生物正交代谢糖标记技术,用双环壬炔(BCN)基团修饰荧光素酶标记的肿瘤细胞(4T1-Luc),通过点击化学反应促进探针与4T1-Luc细胞的精确结合。这种双模态成像方法能够高灵敏度地实时监测微小转移灶,为评估体内肿瘤转移和治疗反应提供了一种非侵入性且准确的方法(图4)。 图4SERS和生物发光双模态成像结合生物标记实时追踪三阴性乳腺癌(TNBC)肿瘤转移示意图:(a) M-SERS 探针的制备;(b) 作用机理及其在肿瘤转移监测中的应用乳腺癌早期诊断对提高患者的生存率至关重要,组织病理学活检是乳腺癌确诊的“金标准”,能够提供肿瘤的组织学类型、分子特征及侵袭程度,从而指导个性化治疗方案。目前,临床主要采用针吸细胞学(FNA)、粗针穿刺活检(CNB)和手术切除活检等方法。组织病理学活检方法因侵入性操作,可能引起感染、出血或组织损伤以及取样不足或未能涵盖关键病变区域导致较高的假阴性率。此外,样本处理和病理分析通常需要数天到数周,可能会延误治疗决策。这些问题促使研究人员探索更高效的替代检测方法。SERS技术因其超高灵敏度、快速检测能力和分子指纹特异性,在乳腺组织活检中展现出巨大潜力。SERS探针可通过微创或非侵入式手段与组织中的特异性生物标志物结合,实现即时检测,降低患者的不适感。SERS信号对分子变化极为敏感,即使是低浓度的生物标志物,也能被高效检测,从而提高诊断准确性。如图5所示,与传统病理方法相比,SERS检测无需复杂的样本制备,可以通过检测乳腺癌组织中的特定生物标志物及其代谢产物的分子指纹特征,实现对肿瘤微环境变化的高灵敏检测,从而预测乳腺癌组织的潜在恶性转化能力。研究表明,SERS结合功能化纳米探针可实现对EMT相关蛋白(如E-cadherin、N-cadherin)的实时检测,揭示肿瘤侵袭性增强的早期信号。通过早期检测这些组织类型的变化,SERS技术能够为MBC和临床干预提供重要的信息,帮助提高治疗的精准性和患者的预后。 图5乳腺癌组织和小鼠异种移植模型中正常相邻组织的拉曼成像:(A) 施用纳米粒子后的切除组织数字照片;(B) 组织样本的拉曼成像;(C) 拉曼成像与组织样本的叠加,注意乳腺癌组织中纳米粒子的结合增加,相较于正常相邻组织;(D) 定量比值分析特定CD47 SERS纳米粒子与非特异性同型IgG SERS纳米粒子在每个组织样本上的结合情况,注意癌症组织与正常相邻组织之间有显著差异,表示为*(P < 0.05);误差条表示标准误(SEM),拉曼图像右侧的颜色条表示拉曼强度,红色表示最高的拉曼信号,黑色表示没有相关的拉曼信号
图3通过表征循环肿瘤细胞表型及其异质性的动态演变追踪上皮-间充质转化过程,其中SERS光谱信号分布曲线的展宽程度与异质性水平呈正相关,同时该技术也可用于单个外泌体的SERS光谱构建:(A) 上皮-间质转化(EMT)过程同时发生于肿瘤原发灶和循环系统,当肿瘤细胞/循环肿瘤细胞(CTCs)暴露于TGF-β等EMT诱导因子时,会导致细胞表型和形态发生从上皮型向间质型的转变;(B) 通过功能化SERS纳米标签标记CTCs后,在激光激发下进行检测;(C) (i) 功能化SERS纳米标签的特征峰分别位于:DTNB (1338 cm⁻¹)、MBA (1080 cm⁻¹)、TFMBA (1379 cm⁻¹)和MPY (1000 cm⁻¹);(ii) 标志物特异性SERS纳米标签的特征峰强度可显示CTCs在上皮状态和间质状态下的EMT相关表型;(iii) 信号分布曲线反映了CTCs在上皮和间质状态下的表型异质性;(D) (i) HER2和MUC1探针的结构示意图;(ii) 探针与外泌体表面HER2和MUC1的特异性结合;(iii) 通过多元曲线分辨-交替最小二乘法(MCR-ALS)将SKBR和MCF细胞来源外泌体的复杂SERS光谱解析为两个组分光谱(CHER2和CMUC1),它们分别与HER2和MUC1探针的SERS光谱高度相似; (E) 经MCR-ALS解析得到的相对SERS强度比(α/β)在SKBR外泌体(n=50)和MCF外泌体(n=50)中的分布情况;(F) 单个SKBR和MCF外泌体的复合SERS光谱(Specexo)可通过两个结合探针SERS光谱的加权求和构建:Specexo = α·CHER2 + β·CMUC1,其中α和β分别代表相应外泌体中HER2和MUC1蛋白标志物的权重(丰度)微小核糖核酸是一类内源性非编码RNA,在调控基因表达、细胞增殖、浸润和迁移等过程中扮演关键角色,其异常表达与乳腺癌的发生和转移密切相关。已有研究指出,ER-/PR-型乳腺癌患者血清中微小RNA-21(microRNA-21,miR-21)、微小RNA-106a(microRNA-106a,miR-106a)和微小RNA-155(microRNA-155,miR-155)显著上调,而微小RNA-126(microRNA-126,miR-126)、微小RNA-199a(microRNA-199a,miR-199a)和微小RNA-335(microRNA-335,miR-335)显著下调,提示miRNAs在乳腺癌分子分型与治疗评估中具有潜在的生物标志物价值。目前主流miRNA检测技术包括Northern印迹杂交(Northern blotting,Northern blot)、实时荧光定量逆转录聚合酶链式反应(Reverse transcription quantitative polymerase chain reaction,RT-qPCR)、次世代测序(Next-generation sequencing,NGS)与微阵列,但它们均存在各自的局限性,如灵敏度不足、耗时较长或标记难度大。因此,亟需一种灵敏度高、操作便捷、可实现高通量分析的新型检测手段。SERS技术因其极高的信号增强能力(增强因子高达1012~1014)和对背景干扰的强耐受性,被认为是实现miRNA精准检测的理想工具。然而,在组织、血清或血浆等复杂临床样本中同时检测多种miRNA仍存在挑战,主要包括:(1)不同miRNA分子的拉曼信号差异细微,难以区分;(2)点对点扫描方式导致整体检测耗时较长。为克服这些限制,研究者提出将SERS与微流控芯片和数字全息成像技术结合,以实现快速、多重、高通量检测。最新研究中开发出一种三维(3D)SERS全息芯片平台,可在9 min内完成乳腺癌相关miRNA的同时定性与定量分析。该系统先通过Exo Ⅲ酶对miRNA进行等温扩增,随后引导扩增产物流入内嵌银纳米颗粒阵列的微流控装置。各miRNA通过打开特异性茎环结构的探针,使荧光染料远离金属基底,造成SERS信号改变。最终通过扫描阵列区域并整合空间-光谱信息,生成可同时识别九种乳腺癌相关miRNA,包括:致死-7b 微小RNA(Lethal-7b microRNA,let-7b)、微小RNA-1(microRNA-1,miR-1)、微小RNA-10b(microRNA-10b,miR-10b)、微小RNA-125b(microRNA-125b ,miR-125b)、miR-126、微小RNA-133a(microRNA-133a,miR-133a)、微小RNA-143(microRNA-143,miR-143)、miR-155、miR-21的3D SERS全息图。该平台最低检测限可达1 aM,在临床样本中表现RT-qPCR约85%的检测一致性,显示出良好的灵敏度与准确性。随着液体活检和无创基准医学理念的发展,SERS在乳腺癌筛查中的应用愈发受到关注。传统乳腺癌筛查方法如乳腺钼靶检查是公认的标准筛查方法,但其在识别早期微小病灶方面存在明显不足,易导致漏诊。此外,乳腺钼靶筛查存在射线暴露风险,不宜频繁检测,且不具备对分子水平异常的识别能力。相比之下,SERS技术具有高灵敏度、高分子特异性和多靶标检测的优势,通过捕捉血清或血浆中的分子指纹特征,为乳腺癌的早期识别提供了新的技术支撑。其次,SERS检测无需复杂的样品前处理或组织采样,仅需少量血液样本即可完成检测,适合广泛的人群筛查。已有研究尝试将SERS谱图与多元统计分析方法(主成分分析PCA、线性判别分析LDA、支持向量机SVM等)结合,建立判别模型,成功区分健康人群与乳腺癌患者的血液样本。这一技术路线具备低成本、高通量、快速响应的优势,为未来基层医疗单位开展无创乳腺癌筛查提供了可行的新工具。除单个癌症类型筛查外,SERS也可用于乳腺癌与其他癌症的鉴别分析。在一项包含253例总血清样本的大规模研究中,研究者收集了来自健康志愿者以及乳腺癌、肺癌、结直肠癌、口腔癌和卵巢癌患者的样本,系统评估了基于SERS光谱的分类准确性。结果显示,SERS技术在不同癌症类型之间的区分中展现出良好的判别能力,提示其在癌症类型特异性筛查与鉴别诊断中的潜在应用价值。术前检测乳腺癌淋巴结转移(Lymph node metastasis, LNM)始终是临床诊疗中的一大难点。为了追踪潜在的转移灶,临床上已广泛应用多种成像技术,包括US、CT、MRI、SPECT以及PET-CT。尽管PET-CT被广泛认为是多种恶性肿瘤影像学检测的“金标准”,其在乳腺癌微小转移灶的识别方面仍面临灵敏度和特异性不足的问题。US检查操作简便、无创、可实时动态成像,常用于评估淋巴结的大小、形态及内部结构。它对深部或体积较小的转移性淋巴结识别能力有限,且对操作人员依赖性强。US的特异性偏低,炎症、感染等良性病变也可能引起淋巴结肿大,导致假阳性率上升,影响诊断准确性。CT在评估解剖结构方面具有较高的空间分辨率,可观察淋巴结大小和钙化情况,但其对微小病灶的分辨能力有限,且主要依赖形态学特征判断,缺乏功能信息,难以准确区分良性和恶性病灶。MRI在软组织成像方面具有出色的对比度,能较好显示乳腺及腋窝区域的解剖细节。MRI成像耗时较长,价格较高,且在微小转移灶尤其是低信号差异病灶的检出方面存在一定局限。SPECT作为功能成像技术,可反映肿瘤组织的代谢和血流情况,用于淋巴引流路径或前哨淋巴结的定位。但其空间分辨率较低,难以明确显示微小结构,且图像易受伪影干扰,不适合精细结构的判断。PET-CT 结合了代谢成像与解剖成像优势,在乳腺癌分期及全身转移评估中应用广泛。尽管其对大体积高代谢病灶具有良好识别能力,但对于低代谢或微小转移灶(尤其是直径< 5 mm的病灶)易漏诊。此外,PET-CT成本高、设备要求高,不适用于常规筛查。传统影像技术在检测乳腺癌微小转移灶方面普遍存在灵敏度不足、特异性有限及空间或代谢分辨率不足等问题。基于形态学判断的方式难以满足早期识别微小转移灶的临床需求,这也促使高灵敏的分子成像技术逐步发展。SERS技术在可视化检测乳腺癌转移病灶中展现出独特优势,尤其在灵敏度、分子特异性及空间分辨率方面表现突出。SERS成像依赖于功能化纳米探针与特定肿瘤相关分子或肿瘤微环境特征(如pH、酶活性)的特异性结合,将拉曼活性分子标记在金属纳米结构表面,通过“热点”效应极大增强信号,实现对微量标志物的可视化追踪。在乳腺癌转移灶检测中,SERS纳米探针可通过主动靶向或被动渗透富集进入转移性淋巴结或远处转移灶。借助拉曼光谱仪,可有效区分转移与非转移组织。相比传统影像模式,SERS能实现对微小转移灶早期、精准的定位和监测,为乳腺癌转移病灶的早期诊断、术中导航及疗效评估提供了强有力的技术支撑。SERS技术凭借其极高的检测灵敏度与分子特异性,有望为乳腺癌转移的早期诊断和精确监测提供全新思路。三阴性乳腺癌作为一种侵袭性极强的乳腺癌亚型,呈现早期转移和不良预后的典型特征,传统检测技术往往缺乏早期检测转移性病变所需的灵敏度和分子特异性。此外,由于缺乏有效的靶向位点,抗体、多肽和适配体等识别单元难以特异性靶向到肿瘤细胞并实时追踪肿瘤转移。为克服以上不足,开发基于SERS和生物发光的双模态成像策略结合生物正交代谢糖标记技术,用双环壬炔(BCN)基团修饰荧光素酶标记的肿瘤细胞(4T1-Luc),通过点击化学反应促进探针与4T1-Luc细胞的精确结合。这种双模态成像方法能够高灵敏度地实时监测微小转移灶,为评估体内肿瘤转移和治疗反应提供了一种非侵入性且准确的方法(图4)。 图4SERS和生物发光双模态成像结合生物标记实时追踪三阴性乳腺癌(TNBC)肿瘤转移示意图:(a) M-SERS 探针的制备;(b) 作用机理及其在肿瘤转移监测中的应用乳腺癌早期诊断对提高患者的生存率至关重要,组织病理学活检是乳腺癌确诊的“金标准”,能够提供肿瘤的组织学类型、分子特征及侵袭程度,从而指导个性化治疗方案。目前,临床主要采用针吸细胞学(FNA)、粗针穿刺活检(CNB)和手术切除活检等方法。组织病理学活检方法因侵入性操作,可能引起感染、出血或组织损伤以及取样不足或未能涵盖关键病变区域导致较高的假阴性率。此外,样本处理和病理分析通常需要数天到数周,可能会延误治疗决策。这些问题促使研究人员探索更高效的替代检测方法。SERS技术因其超高灵敏度、快速检测能力和分子指纹特异性,在乳腺组织活检中展现出巨大潜力。SERS探针可通过微创或非侵入式手段与组织中的特异性生物标志物结合,实现即时检测,降低患者的不适感。SERS信号对分子变化极为敏感,即使是低浓度的生物标志物,也能被高效检测,从而提高诊断准确性。如图5所示,与传统病理方法相比,SERS检测无需复杂的样本制备,可以通过检测乳腺癌组织中的特定生物标志物及其代谢产物的分子指纹特征,实现对肿瘤微环境变化的高灵敏检测,从而预测乳腺癌组织的潜在恶性转化能力。研究表明,SERS结合功能化纳米探针可实现对EMT相关蛋白(如E-cadherin、N-cadherin)的实时检测,揭示肿瘤侵袭性增强的早期信号。通过早期检测这些组织类型的变化,SERS技术能够为MBC和临床干预提供重要的信息,帮助提高治疗的精准性和患者的预后。 图5乳腺癌组织和小鼠异种移植模型中正常相邻组织的拉曼成像:(A) 施用纳米粒子后的切除组织数字照片;(B) 组织样本的拉曼成像;(C) 拉曼成像与组织样本的叠加,注意乳腺癌组织中纳米粒子的结合增加,相较于正常相邻组织;(D) 定量比值分析特定CD47 SERS纳米粒子与非特异性同型IgG SERS纳米粒子在每个组织样本上的结合情况,注意癌症组织与正常相邻组织之间有显著差异,表示为*(P < 0.05);误差条表示标准误(SEM),拉曼图像右侧的颜色条表示拉曼强度,红色表示最高的拉曼信号,黑色表示没有相关的拉曼信号
4 SERS技术评估疗效
在乳腺癌治疗中,疗效评估具有重要临床价值。不同患者之间存在明显的个体差异,治疗反应各异,科学评估疗效不仅有助于判断疾病进展、优化治疗策略,还能避免无效或过度治疗,提升治疗精准度与患者生存质量。目前,临床主要依赖影像学技术以及血清肿瘤标志物,如癌抗原15-3(Cancer antigen 15-3,CA15-3)和癌胚抗原(Carcinoembryonic antigen,CEA)进行治疗监测。这些方法在检测灵敏度和特异性方面仍存在局限,尤其在早期阶段往往无法准确反映治疗效果。因此,急需开发更高灵敏度、更具时效性和特异性的分子诊断技术。
乳腺癌亚型种类较多,且相关肿瘤细胞系复杂,SERS技术可针对乳腺癌不同分子亚型的疗效进行有效评估。乳腺癌的分子分型通常依据雌激素受体(Estrogen receptor,ER)、孕激素受体(Progesterone receptor,PR)和人表皮生长因子受体-2(Human epidermal growth factor receptor 2,HER2)的表达情况进行评估。ER和PR在约75%的乳腺癌中表达,它们是激素治疗的预后标志物,其表达为阳性通常显示具有较低的侵袭性。HER2过度表达的乳腺癌约占15%,其侵袭性较强,但对HER2靶向治疗反应较好。其余10%~15%的乳腺癌为三阴性乳腺癌(Triple negative breast cancer,TNBC),这种类型缺乏ER、PR和HER2的表达,通常为高级别,且预后较差。激素受体阳性乳腺癌(ER+/PR+)对激素治疗(如选择性雌激素受体调节剂他莫昔芬、芳香化酶抑制剂来曲唑)响应良好。SERS可通过检测雌激素代谢物、ER表达或相关基因(ESR1)突变,识别耐药风险并辅助调整方案。HER2阳性乳腺癌,对靶向药物(如曲妥珠单抗、帕妥珠单抗)更为敏感,SERS可用于动态检测HER2、CTCs表达变化,评估是否适合抗体-药物偶联物(antibody-drug conjugate,ADC)治疗。在转移性乳腺癌伴随诊断中,监测药物疗效至关重要,针对HER2过表达的小鼠尿液外泌体发展了一种基于SERS免疫分析的深度学习辅助曲妥珠单抗疗效的监测方法(图6)。利用SERS-深度学习分析检测了五种细胞来源外泌体的抗原水平,从而分析监测药物疗效。图6 用于监测曲妥珠单抗在乳腺癌患者中的疗效的外泌体生物标志物的深度学习辅助SERS免疫测定的示意图乳腺癌转移与肿瘤细胞表面标志物及微环境密切相关,目前临床仍面临灵敏度不足和治疗评估困难的问题。为此,研究者开发了一种金银核壳纳米探针,通过靶向抗体和拉曼报告分子的修饰,实现了对肿瘤标志物的高灵敏度检测。在乳腺癌异种移植模型中,探针通过全身给药方式成功实现肿瘤标志物的动态监测,为治疗效果评估和手术切除范围确定提供了分子影像学依据。由于微小肿瘤切除不彻底,乳腺肿瘤手术常常面临术后致命性复发的风险。如能精确勾画肿瘤边缘并在术中实时清除微小肿瘤病灶,从而彻底切除肿瘤,将显著改善手术疗效,且降低肿瘤复发概率。基于靶向HER2的适配体构建的SERS探针具有超高检测灵敏度,且能显著抑制HER2的表达和细胞增殖,进而利用光热消融肿瘤细胞。在HER2阳性乳腺肿瘤小鼠模型中,可通过SERS成像引导手术切除和术中实时光热消除,能有效抑制肿瘤复发。保乳手术因其创伤小和美容效果好,成为乳腺癌患者的理想选择,但肿瘤切除不完全常导致复发。基于SERS的手术策略,能精确标定肿瘤边缘并实时消除显微肿瘤,确保肿瘤的完全切除,避免局部复发(图7)。该策略通过靶向HER2的SERS探针,结合高灵敏度检测、细胞增殖抑制和光热消融功能,在HER2阳性乳腺肿瘤小鼠模型中取得了100%的无瘤生存率,预示该方法有望提高HER2阳性乳腺癌患者的生存率。图7 表面增强拉曼散射成像引导的乳腺癌转移诊疗:(A) SERS成像引导手术流程图,包括术前肿瘤边缘勾画指导保乳手术、术中SERS检测以及实时光热消除手术床残留的微观肿瘤病灶三部分;(B) SERS探针结构示意图:以等离子金纳米星(AuSt)为核心,表面包裹对硝基苯硫酚(p-NTP)拉曼分子层,外层覆以二氧化硅壳层,最终通过HER2特异性适配体(HApt)实现靶向功能化;(C) SERS探针在HER2阳性乳腺癌荷瘤小鼠体内通过静脉给药后,借助增强渗透与滞留(EPR)效应及适配体HApt介导的主动靶向机制在肿瘤部位富集SERS成像技术还可与治疗手段相结合,构建“诊疗一体化”系统,为乳腺癌的精准治疗和疗效评估提供新路径。通过在贵金属纳米颗粒表面修饰特异性靶向配体(如抗体、适配体)以及治疗分子(如光敏剂或化疗药物),可构建具有成像与治疗双重功能的SERS探针。这类探针不仅能够实现肿瘤组织的高灵敏、特异性定位和实时拉曼成像,还可在激光照射下激发治疗反应,完成光动力治疗(Photodynamic therapy,PDT)或光热治疗(Photothermal therapy, PTT),实现对肿瘤细胞的精准消融。近年来,人工智能(Artificial Intelligence,AI)技术的迅猛发展为复杂的SERS光谱数据分析提供了全新思路。借助深度学习、机器学习和模式识别等先进算法,AI能够高效从高维、复杂的SERS光谱中自动提取关键特征,显著提升数据处理效率与诊断准确率。更重要的是,AI可整合患者的多组学信息(如基因组、转录组、代谢组等),构建个体化风险评估与预后预测模型,为制定精准治疗策略提供坚实的数据支撑。AI算法在光谱背景校正、信号去噪及分类识别方面也表现出优越性能,特别是在区分良恶性病灶、识别乳腺癌分子亚型及追踪治疗响应过程中展现出巨大潜力。如图8所示,随着多功能纳米材料的不断优化、AI分析技术的深入融合以及临床大数据的积累,基于SERS的人工智能平台有望成为乳腺癌转移诊断与疗效评估的重要组成部分,助力精准医疗落地临床。基于SERS与人工神经网络(Artificial neutral network,ANN)相结合的外泌体分析方法,用于乳腺癌分子分型识别与术后疗效评估。首先采集了来自四种代表性的乳腺癌细胞系所分泌的外泌体包括MDA-MB-231(三阴性乳腺癌)、MCF-7(Luminal A)、BT474(Luminal B)和SKBR-3(HER2+)。如图9(A~E)所示,获取共计8265组SERS光谱数据,这些数据用于ANN模型的训练与验证,训练集与验证集按8∶2比例划分,并引入交叉验证和早停策略,以降低过拟合风险并提升模型的泛化能力。在模型训练过程中,ANN在验证集上表现出89.1%的识别准确率,显示出较高的稳定性与重现性。进一步地,该模型被应用于临床乳腺癌患者血清外泌体的SERS数据分析。如图9(F, G)所示,在未接受手术的患者中,ANN模型对不同乳腺癌亚型的识别准确率达到100%,反映其在实际临床分型中的潜在应用价值。SERS-ANN联合策略在乳腺癌亚型识别与疗效动态评估中展现出良好的前景,尤其在外泌体为基础的无创液体活检中具有广阔的应用潜力。图8 人工智能在SERS流程中的整合:优化流程与拓展应用:(A) 在整个SERS流程中,人工智能可用于SERS基底、报告分子及其合成路线的设计,仪器优化和数据预处理方法的改进,以及SERS相关应用的推动;(B) 人工智能辅助的SERS应用方面;(C) 定性分析用于确认未知样品中是否存在特定分子物种;(D) PCA-TLNN促进靶标识别图9 基于SERS特征构建的深度学习辅助ANN模型,用于乳腺癌分类及血清外泌体预测:(A) ANN模型结构图,包括一个输入层、四个全连接的隐藏层和一个输出层,最终输出为四个介于0到1之间的数值,分别对应四种细胞来源外泌体的预测概率。输入层共引入8265组细胞来源外泌体的SERS光谱数据,分别为MDA-MB-231(2125条)、MCF-7(1900条)、BT474(1800条)和SKBR-3(2440条);(B) 分别来源于MDA-MB-231、MCF-7、BT474和SKBR-3细胞的外泌体SERS光谱图(阴影部分表示标准差);(C) 训练集和验证集的交叉熵损失函数和准确率变化曲线;(D) 经过10次重复训练后所得训练集和验证集的最终准确率与交叉熵损失值;(E) 基于合并的细胞来源外泌体SERS数据集,对MDA-MB-231、MCF-7、BT474和SKBR-3的预测结果混淆矩阵;(F) 从患者血清中分离纯化外泌体的示意图,该过程结合了尺寸排阻色谱法和超滤技术;(G) 经过训练的ANN模型对(i)预测试数据集和(ii)测试数据集的预测得分。预测试数据集来自于各类细胞外泌体加入其对应患者血清外泌体洗脱液后的光谱数据,测试数据集来自实际分离的患者血清外泌体光谱数据。图中颜色条表示预测频率的取值范围(0到1);(H) 不同乳腺癌亚型患者在有无手术干预情况下,血清外泌体SERS光谱的输出评分频率曲线图为推动SERS技术从实验室走向临床,其在临床前研究阶段的系统性验证尤为关键。目前,已有多个动物模型实验验证了SERS探针在乳腺癌疗效评估中的实用性。在HER2+乳腺癌小鼠异种移植模型中,SERS探针不仅能清晰描绘肿瘤边界,还能结合光热治疗实现病灶的消融,从而减少术后复发的风险。此外,SERS技术已用于追踪外泌体中HER2/MUC1表达水平变化,并通过深度学习算法辅助评估治疗效果,其在小鼠尿液样本中的检测结果与传统蛋白质印迹法高度一致,进一步增强了技术的可靠性与可转化性。与此同时,SERS探针的生物相容性和安全性评价也在多项临床前研究中进行了评估,通过在探针表面修饰聚乙二醇或生物可降解材料,能有效降低探针在循环过程中的蛋白质吸附,避免蛋白冠的形成,进而有效改善其体内稳定性和免疫逃逸能力。毒理学研究亦表明,合理设计的SERS探针在体内表现出较低的系统毒性与良好的代谢清除特征,具备良好的安全性。综上,临床前的系统研究不仅能验证SERS探针在乳腺癌诊断与疗效评估中的可行性,也为后续临床试验提供了关键数据支撑和理论依据,是实现“实验室到床旁边”转化过程中不可或缺的关键环节。MBC由于其高度异质性及分子标志物低表达的生物学特征,对检测技术的灵敏度与特异性提出了更为苛刻的要求。SERS技术因其独特的分子指纹识别能力和超高信噪比,已成为肿瘤早期筛查、转移监测及疗效评估领域的重要工具。在多技术融合方面,SERS与先进平台的集成显著拓展了其在乳腺癌转移检测与治疗中的应用潜力。与光学成像技术(如光声成像、荧光成像)联合应用,可兼顾高分子分辨率与较强组织穿透能力,实现对深层肿瘤组织的精准定位与实时动态追踪。与微流控平台的结合,则有助于在复杂液体样本中高效富集CTCs,提升液体活检的灵敏度与特异性。同时,通过识别关键膜蛋白,SERS还可辅助揭示肿瘤细胞的侵袭与转移机制,为肿瘤转移早期预警提供分子依据。
SERS作为一种集分子识别、无损成像与治疗评估于一体的新型诊疗平台,正在重塑乳腺癌转移检测的技术格局。AI可以通过深度学习和机器学习算法自动化处理复杂的SERS光谱数据,提取关键特征,并进行分类与量化分析。这一过程不仅提高了乳腺肿瘤标志物的检测效率,还能结合患者的临床信息,构建转移预测模型,为个性化治疗提供数据支持。尽管SERS技术在基础研究阶段取得了显著进展,其向临床转化过程中仍面临一系列亟待解决的挑战。首先,复杂的体内微环境可能引入背景噪声,干扰拉曼信号的稳定性,易导致波动或假阳性结果,降低检测的准确性。其次,金属纳米材料在规模化制备过程中常出现批次间差异,进而影响SERS基底的性能稳定性与结果可重复性。部分纳米材料可能在体内引发免疫反应或潜在毒性,对其生物安全性提出更高要求。为推动SERS技术从“实验台”向“病床边”有效过渡,亟需加强床前研究的深度与广度。当前应重点发展具有高灵敏性、良好批次稳定性、低毒性及可标准化制备的SERS基底,并通过动物模型验证其在复杂生理环境下的成像稳定性与分布特征。在此基础上,应结合外泌体、循环肿瘤细胞(CTCs)等液体活检标志物,构建与乳腺癌转移路径密切相关的动态监测平台,系统评估SERS纳米探针在转移部位的富集能力、靶向性及代谢安全性。这些问题在一定程度上限制了SERS技术在临床中的广泛应用。为提升SERS在乳腺癌转移性检测中的临床可行性,未来研究需重点聚焦于开发高稳定性、低毒性、具有良好生物相容性且易于标准化的大规模制备的SERS基底。同时,应进一步优化纳米探针的结构设计,提升其靶向性、组织穿透能力与代谢安全性,从源头提升检测的可靠性与适应性。这为提高乳腺癌治疗效果、延缓疾病进展、改善患者生存质量提供了新策略。通过持续的技术创新和多学科交叉融合,SERS将在乳腺癌转移早期诊断、动态监测及个体化治疗评估中发挥越来越核心的作用,为患者带来更早、更准、更有效的干预策略。· 编辑推荐 · Editor's Recommendation 推文篇幅有限,欢迎阅读原文,共飨学术
化学进展
《化学进展》是由中国科学院主管, 以刊登化学领域综述与评论性文章为主的学术性期刊。读者可从中了解化学专业领域国内外研究动向、最新研究成果及发展趋势。主要栏目有:综述与评论,专题论坛,科学基金,基础研究论文评介,动态与信息等。
445篇原创内容
公众号

